Hiđrocacbon là hợp chất hữu cơ chỉ được cấu tạo từ C và H, được ứng dụng trong nhiều lĩnh vực. Vậy chúng ta hãy cùng tìm hiểu xem Hydrocarbon là gì? Nó được phân loại ra sao và có ứng dụng gì trong cuộc sống.
- 1. Hydrocarbon là gì?
- 2. Tính chất và ứng dụng từng nhóm Hidrocacbon
- 2.1. Hiđrocacbon no
- 2.2. Hiđrocacbon không no
- 2.3. Hydrocarbon thơm
- 3. Hidrocarbon mua ở đâu giá tốt?
1. Hydrocarbon là gì?
Hiđrocacbon là hợp chất hữu cơ mà trong phân tử chỉ có 2 hợp chất là cacbon (C) và hiđro (H).
Tuỳ theo loại liên kết đơn, đôi hay đa mà nó được phân chia ra thành 3 nhóm chính gồm:
- Hiđrocacbon no.
- Hiđrocacbon không no.
- Hiđrocacbon thơm.
2. Tính chất và ứng dụng từng nhóm Hidrocacbon
2.1. Hiđrocacbon no
2.1.1. Định nghĩa
Hidrocarbon no là hợp chất chỉ chứa các liên kết đơn của các nguyên tử carbon trong phân tử. Những vị trí còn lại sẽ được bão hòa bởi các nguyên tử hydro.
2.1.2. Phân loại
Hidrocacbon no gồm 2 nhóm chính:
- Nhóm 1: Ankan có công thức tổng quát là CnH2n+2 (n≥1), tồn tại dưới dạng mạch hở.
- Nhóm 2: Cycloankan với công thức tổng quát CnH2n (n≥3), tạo thành vòng.
2.1.3. Tính chất, điều chế, ứng dụng
* Ankan

Hợp chất ankan
- Tính chất vật lý:
+ Ở nhiệt độ thường: Các ankan từ C1 đến C4 tồn tại ở dạng khí, C5 - C18 ở trạng thái lỏng, từ C18 trở lên sẽ ở trạng thái rắn.
+ Nhiệt độ nóng chảy, nhiệt độ sôi và khối lượng riêng đa phần sẽ tăng dần theo số nguyên tử C có trong phân tử.
+ Nhẹ hơn nước, không tan trong nước nên sẽ nổ trên mặt nước. Hầu hết đều là những chất không màu.
- Tính chất hoá học:
+ Tham gia phản ứng thế với halogen: Clo có thể thay thế lần lượt từng nguyên tử H trong phân tử Metan. Chú ý: Sản phẩm thế sẽ ưu tiên vị trí H ở C bậc cao.
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
+ Phản ứng tách hay còn gọi là phản ứng đề hidro hóa.
+ Phản ứng cracking là phản ứng làm gãy mạch cacbon.
+ Phản ứng oxi hóa hoàn toàn tạo ra CO2 và H20 với phương trình tổng quát:
CnH2n+2 + (3n+1)/2 O2 → n CO2 + (n+1)H2O
- Điều chế: Được tổng hợp từ quá trình hydro hóa hợp chất ankin, anken với tác nhân xúc tác là nhiệt độ và Pt, Ni hoặc Pd.
CnH2n +H2 -> CnH2n+2
- Ứng dụng: Làm nhiên liệu, dung môi, dầu bôi trơn máy. Ngoài ra, còn dùng để sản xuất chất sinh hàn.
* Xicloankan
- Tính chất hoá học:
+ Phản ứng thế: Dưới tác động của ánh sáng hoặc nhiệt độ, nguyên tử hidro sẽ bị thay thế bằng nhóm halogen..
+ Phản ứng tách mở vòng để tạo hydrocarbon mạch hở.
+ Riêng Cyclopropan có phản ứng với dung dịch nước brom hoặc axit.
+ Phản ứng oxy hoá: Khi đốt cháy Xicloankan sẽ tạo ra CO2 và H20.
2.2. Hiđrocacbon không no
2.2.1. Định nghĩa
Là hiđrocacbon có chứa tối thiểu một liên kết đôi trong cấu trúc phân tử. Nó tồn tại dưới dạng mạch thẳng hoặc phân nhánh.
2.2.2. Phân loại
Hydrocacbon không no được phân thành các nhóm chính sau;
- Nhóm 1: Anken (???2? với ?≥2), chỉ có 1 liên kết đôi.
- Nhóm 2: Ankadien (???2?−2 với ?≥3). Trong đó có 2 liên kết đôi trong cấu trúc phân tử.
- Nhóm 3: Ankin (???2?−2 với ?≥2). Trong phân tử chỉ có một liên kết ba.
- Nhóm 4: Dạng hỗn hợp. Trong phân tử có thể tồn tại cả liên kết đôi và liên kết ba.
2.2.3. Tính chất đặc trưng
* Tính chất vật lý
- Từ C1 đến C4: Tồn tại dưới dạng chất khí, không màu, không mùi.
- Từ C5 đến C17: Tồn tại dưới dạng chất lỏng.
- Từ C18 trở lên: Tồn tại dưới dạng chất rắn.
* Tính chất hoá học
- Phản ứng thế: Xảy ra ở điều kiện thường với tác nhân xúc tác là ánh sáng và nhiệt độ. Tuy nhiên, halogen dễ thế vào hydro có bậc cao hơn.
- Phản ứng oxy hóa hoàn toàn:
CnH2n + 3n/2O2 → nCO2 + nH2O
CnH2n-2 + (3n-1)/2O2→ nCO2 + (n-1)H2O
- Đốt cháy không hoàn toàn (đề hydro hóa), tạo ra hợp chất anken.
CnH2n+2 → CnH2n + H2
2.2.4. Điều chế
- Các hydrocarbon không no có thể được tạo thành từ việc khai thác dầu mỏ, khí tự nhiên qua quá trình cracking và chưng cất phân đoạn.
- Phương pháp tăng mạch cacbon thông qua các phản ứng trùng hợp, cộng hydro. Chẳng hạn như:
C2H5OH → C2H4 + H2O
C2H6 → C2H4 +H2
2C2H2→ C4H4 (nhị hợp)
3C2H2→ C6H6 (tam hợp)
C4H4 + H2→ C4H8
2.3. Hydrocarbon thơm
2.3.1. Định nghĩa
Hidrocacbon thơm là hợp chất benzen và đồng đẳng của nó, gồm có một hoặc nhiều nhân thơm, ở dạng mạch vòng, có nhánh hoặc không.
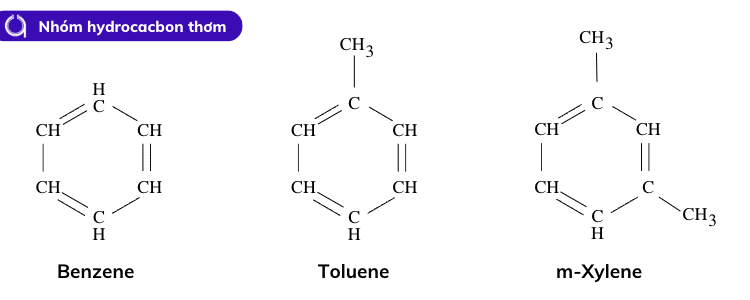
Các hợp chất hidrocarbon thơm
2.3.2. Phân loại
Benzen và dãy đồng đẳng của benzen gồm các hiđrocacbon thơm khác với công thức phân tử chung ???2?−6 (?≥6).
2.3.3. Tính chất đặc trưng
- Tương tự các hợp chất hydrocarbon khác, chúng có phản ứng thế với halogen.
- Tác dụng với axit nitric.
- Phản ứng cộng hợp
- Phản ứng oxi hóa không hoàn toàn và đốt cháy.
2.3.4. Ứng dụng
Trong các hợp chất H-C thơm thì benzen và toluen là hoá chất chính có nhiều ứng dụng trong công nghiệp. Chúng là thành phần để tổng hợp nên các hoạt chất khác.
Hiện nay, benzen, toluen được sản xuất chính từ nhựa than đá và từ sản phẩm đề hiđro đóng vòng hexan, heptan tương ứng.
3. Hidrocarbon mua ở đâu giá tốt?
Hiện tại LabVIETCHEM đang phân phối rất nhiều sản phẩm hidrocacbon như:
- Hidrocacbon no: Hexanes, Isohexane, n-Undecane,...
- Hidrocarbon không no: 2-methyl-1-pentene, 2-Methyl-2-butene,...
- Hidrocarbon thơm: Phenylacetylene, 1,2,4 - Trimethylbenzene,...
Nếu có bất kỳ thắc mắc gì bạn có thể liên hệ với đội ngũ chuyên viên của chúng tôi qua đường dây nóng để 0826 020 020 được tư vấn miễn phí.